Температура кипения нефти колеблется в широких пределах - от 70 до 250 °С. Одной из примечательных особенностей нефти является ее способность растворять огромное количество углеводородных газов - до 400 м3 в 1 м3 нефти (в зависимости от состава нефти и газа, величин давления и температуры) и самой растворяться в них (обратная, ретроградная растворимость) - до 400 г нефти в 1 м3 газа. При этом чем больше в нефти растворено газа, тем меньше ее плотность и вязкость.
Использование нефти в качестве энергетического сырья связано с ее максимальной для минеральных топлив теплотворной способностью 42 тыс. кДж/кг. Для сравнения отметим, что теплотворная способность (в кДж/кг) составляет: торфа - 10 500-14 700, каменного угля - 21 000-30 240, антрацита - 27 300-31 500.
Нефть обладает рядом интересных оптических свойств: она может люминесцировать - светиться под ультрафиолетовыми лучами, вращать плоскость поляризации светового луча и т.д. Молекулярный вес нефти обычно колеблется в пределах 240-290, иногда превышая эту величину. Изменение всех физических свойств нефтей связано с изменением их химического состава.
Из каких же элементов состоит нефть? Главным ее компонентом является углерод, составляющий от 83 до 87% нефти. Второе место занимает водород, содержание которого обычно колеблется в пределах 12-14%. Третье место в составе нефти принадлежит группе так называемых гетероэлементов: кислорода, азота и серы, суммарное содержание которых может достигать 5-8%, но обычно бывает меньше.
В нефти в весьма небольших количествах встречаются фосфор, ванадий, никель, железо, алюминий, кальций, магний, барий, стронций, марганец, хром, кобальт, молибден, бор и другие элементы (всего 44). Серу и различные элементы, содержащиеся в нефти, можно извлекать, в связи с чем нефть следует рассматривать не только в качестве энергетического сырья, но и как сырье для получения этих элементов.
В нефти и горючих газах углерод и водород содержатся в виде удивительнейших и огромнейших групп соединений - углеводородов, отличающихся исключительным разнообразием, изменчивостью состава и строения и широким распространением, особенно в растительных и животных организмах.
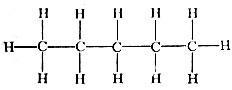
По соотношению углерода и водорода углеводороды дифференцируются на три большие группы: 1) парафиновые, или насыщенные, в химии чаще всего выделяемые под названием алканов; 2) нафтеновые, или полиметиленовые, и 3) ароматические (арены). Парафиновые углеводороды имеют общую формулу CnH2n+2. Первые члены этой группы - газы: метан - СН4, этан - С2Н6, пропан - С3Н8 и бутан - С4Н10. Углеводороды с числом углеводородных атомов от 5 до 15 - жидкие, а с более высоким числом - твердые. Мало того, алканы одного и того же состава могут иметь молекулы нормального строения и изостроения, разветвленные. Благодаря этому, начиная с бутана, наряду с углеводородами нормального строения имеются углеводороды изостроения, причем число изомеров растет одновременно с числом углеродных атомов: у пентана два изомера, у гексана четыре, у октана 17, углеводорода O2H26 имеет более 300 изомеров, углеводород C13H28 - 800 изомеров и т. д.
Изобутан (СН3)2СН⋅СН3; точка кипения - 10,2°С
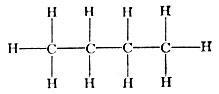
н - бутан СН3(СН2)2СН3; точка кипения - 0,5°С
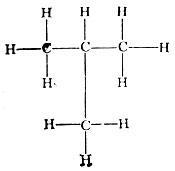
Изопентан CH (СН3)2СH2СН3; точка кипения 28°С
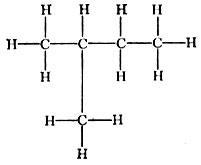
н - центам СН3(СН2)3СН3: точка кипения 36°С
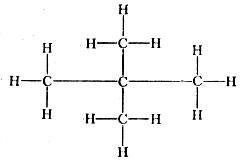
Третичный пентан, неопентан, тетраметилметан или 2,2-димстилпропа:' С(СН3)4 Точка кипения 9,45°С
Нафтеновые углеводороду, содержащиеся в нефти, имеют циклическое строение. Поэтому их иногда называют цикланами или насыщенными циклическими СnН2n. Циклы состоят из пяти (циклопентан) или шести (циклогексан) атомов углерода. При этом таких циклов бывает несколько, в связи с чем к названию добавляется приставка моно-, би-, три- или тетра-.
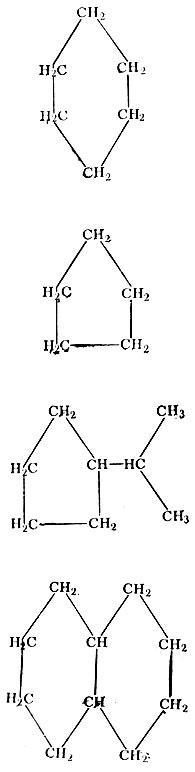
Циклическое строение
Кроме того, циклы имеют еще и боковые цепи. В этой группе, начиная с углеводорода С4Н8, встречаются изомеры, число которых также увеличивается с возрастанием числа углеродных атомов: у C6H12 - 13 изомеров, у C7H14 - 27 изомеров и т. д.
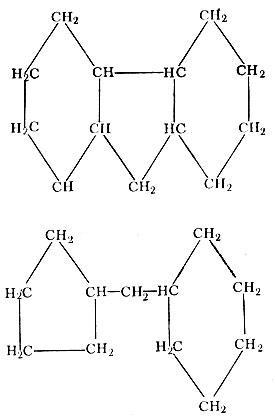
Боковые цепи
Ароматические углеводороды, имеющие общую формулу СnН2n-6, обычно содержатся в нефти в меньших количествах, чем углеводороды двух описанных выше групп. Они также имеют преимущественно циклическое строение, но между отдельными атомами углерода в них в отличие от нафтенов наряду с одинарными связями имеются и двойные.
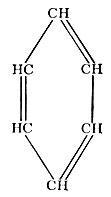
Бензол
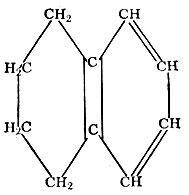
Тетралин
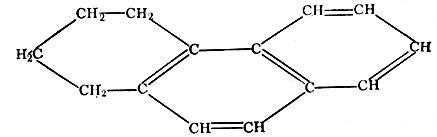
Тетрагидрофенантрен
Кроме того, в отдельных группах водород замещается метильной группой СН3. Ароматические углеводороды нефти могут содержать один, два и более циклов и соответственно называются моно-, би-, три- и тетра-циклическими.
Наконец, еще в нефти содержатся нафтеново-ароматические углеводороды.
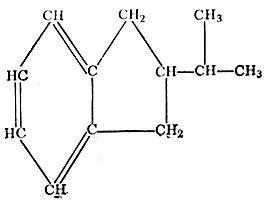
Нафтеново-ароматические углеводороды
Всего в нефти к настоящему времени определено 425 индивидуальных углеводородов, в действительность же их значительно больше.
Гетероэлементы (сера, азот и кислород) обычно содержатся в нефти в виде сложных соединений, ядрами которых являются углеводороды, и значительно реже - в чистом виде. Общее число определенных гетеросоединений превышает 380, из них сернистых 250. Кроме того, в строении сложных органических соединений участвуют фосфор, уран, ванадий, никель, кобальт, иод, бор и другие элементы. Существенную часть в нефти составляют смолы и асфальтены, химическая природа которых достаточно точно не определена. При этом чем тяжелее нефть, тем выше ее плотность и тем больше она содержит смол асфальтенов.
В нефти содержатся еще и металлоорганические комплексы, представляющие собой по строению сложные полициклические углеводороды, в молекуле которых отдельные атомы водорода или метальные группы замещены атомами металлов. Среди них особое значение, как отмечалось, имеют порфирины, являющиеся производными хлорофилла и гемоглобина.
Всего в нефти индентифицировано более 900 индивидуальных химических соединений, причем ни в одном из ее образцов не определены полностью все имеющиеся в нем индивидуальные соединения.
К настоящему времени удалось изучить распределение в нефти изотопов некоторых элементов - углерода, серы и водорода (табл. 1). Как известно, изотопами называются атомы, имеющие одинаковые количества протонов, но разное количество нейтронов (N) и, как следствие этого, обладающие разным массовым числом (А) или атомной массой.
< border="0"> Таблица 1. Некоторые сведения об изотопах водорода, углерода и серы Z Элемент N A Относительная распространенность ат. % 1 Водород Н 0 1 99,9844 1 Дейтерий Д 1 2 0,0156 1 Тритий Т 2 3 - 6 Углерод С 6 12 98,892 6 Углерод С 7 13 1,108 6 Углерод С 8 14 - 16 Сера S 16 32 95,1 16 Сера S 17 33 0,74 16 Сера S 18 34 4,2 16 Сера S 20 36 0,016
